Guía completa para la modelización de proteínas en biología

La modelización de proteínas es un campo fascinante y esencial dentro de la biología molecular que nos permite entender la estructura y función de las proteínas a un nivel más profundo. Este proceso es fundamental debido a que las proteínas son biomoléculas cruciales que participan en casi todos los procesos biológicos y, por lo tanto, su correcta modelización puede aumentar nuestra comprensión de enfermedades, el desarrollo de fármacos y la ingeniería de proteínas para aplicaciones biotecnológicas. A medida que la tecnología avanza, la capacidad de modelar proteínas se ha vuelto más sofisticada y accesible, ofreciendo nuevas oportunidades tanto en la investigación científica como en la medicina.
En este artículo, exploraremos todos los aspectos relacionados con la modelización de proteínas, desde los conceptos básicos y las técnicas utilizadas hasta las aplicaciones prácticas y los desafíos que enfrenta esta disciplina. La modelización de proteínas no solo involucra la representación gráfica de estas moléculas, sino que también implica la interpretación de datos experimentalmente obtenidos y la utilización de herramientas computacionales para simular comportamientos moleculares. A lo largo de este artículo, proporcionaremos un análisis exhaustivo que será útil tanto para principiantes como para aquellos que ya tienen experiencia en el campo de la biología. Empecemos a desglosar este apasionante tema.
Fundamentos de la modelización de proteínas
Para comprender la modelización de proteínas, es vital tener una idea clara de la estructura básica de las proteínas. Las proteínas están formadas por cadenas de aminoácidos, que se pliegan en estructuras tridimensionales específicas. Este plegamiento es crucial porque determina la función de la proteína. Existen cuatro niveles de organización estructural en las proteínas: estructura primaria, secundaria, terciaria y cuaternaria. La estructura primaria se refiere a la secuencia lineal de aminoácidos; la secundaria implica la formación de hélices alfa y láminas beta; la terciaria se refiere al plegamiento tridimensional de una sola cadena polipeptídica, y finalmente, la cuaternaria describe la asociación de varias cadenas polipeptídicas para formar una proteína funcional completa.
La modelización implica la predicción y representación computacional de estas estructuras basándose en la información que se tiene sobre la secuencia de aminoácidos. Hay distintas aproximaciones para modelar la estructura de las proteínas, incluyendo la modelación por homología, que utiliza la estructura de proteínas homologas (aquellas con una secuencia similar) como plantillas, y la modelización de novo, que intenta predecir la estructura de una proteína desde cero sin utilizar ninguna estructura existente. La elección del método depende de la cantidad de información disponible sobre la proteína en cuestión y los recursos computacionales disponibles.
Técnicas utilizadas en la modelización de proteínas
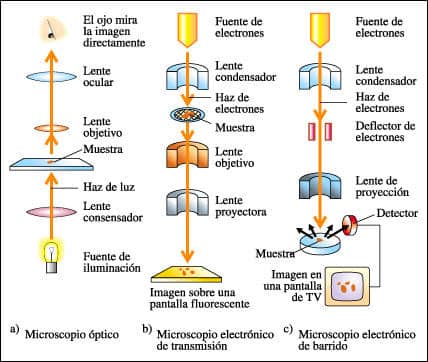
La modelización de proteínas se basa en una variedad de técnicas que han evolucionado con el tiempo. Una de las técnicas más comunes es la cristalografía de rayos X, que permite obtener imágenes tridimensionales de proteínas en forma cristalina. Este método es muy poderoso, aunque laborioso, y requiere que las proteínas se cristalicen adecuadamente, lo que no siempre es factible. Otra técnica ampliamente utilizada es la resonancia magnética nuclear (RMN), que puede proporcionar información sobre la estructura de proteínas en solución, lo que es útil para entender el comportamiento dinámico de estas moléculas.
Las simulaciones de dinámica molecular son otra herramienta crucial en la modelización de proteínas. Estas simulaciones permiten estudiar cómo las proteínas interactúan con otras moléculas y cómo su estructura puede cambiar en respuesta a diferentes condiciones. A través de software avanzado y potentes recursos computacionales, los investigadores pueden observar estas interacciones a nivel molecular, obteniendo información invaluable sobre la funcionalidad de la proteína. También se están incorporando enfoques de inteligencia artificial y aprendizaje automático para predecir estructuras proteicas y facilitar el proceso de modelización, como es el caso de AlphaFold, que ha revolucionado la manera en que abordamos esta tarea.
Aplicaciones de la modelización de proteínas en biología
Las aplicaciones de la modelización de proteínas son vastas y significativas en varios campos dentro de la biología y la medicina. Una aplicación clave es la investigación farmacológica. La comprensión de la estructura de una proteína puede ayudar en el diseño de fármacos, ya que permite a los investigadores modelar cómo compuestos específicos interactuarán con dianas terapéuticas. Esta aproximación ha sido fundamental en el desarrollo de medicamentos dirigidos que pueden, por ejemplo, inhibir la acción de proteínas asociadas a enfermedades como el cáncer o la diabetes.
Además, la modelización de proteínas permite investigar mecanismos de enfermedades a nivel molecular. Al entender cómo una proteína se pliega y cuáles son las consecuencias de su mal plegamiento, los científicos pueden identificar nuevas estrategias para tratamientos y terapias. También se utiliza en la ingeniería de proteínas, donde se diseñan proteínas con funciones específicas para diversas aplicaciones industriales, en biotecnología, o incluso en la creación de soluciones biológicas para problemas de sostenibilidad y medio ambiente.
Desafíos en la modelización de proteínas
A pesar de los avances en el campo, la modelización de proteínas viene acompañada de una serie de desafíos. Uno de los principales retos es la dificultad de modelar estructuras de proteínas de gran complejidad y que son muy dinámicas en su forma natural. Muchas proteínas experimentan cambios en su conformación al interactuar con otras moléculas, lo que hace que sea complicado prever con precisión su comportamiento sin realizar estudios experimentales complementarios. Además, la calidad de los modelos puede verse afectada por la disponibilidad limitada de estructuras de proteínas homologas que se puedan usar como plantilla.
Los recursos computacionales son otro desafío. La modelización de proteínas requiere una considerable cantidad de datos y potencia de procesamiento, lo que limita su accesibilidad. Además, a medida que se generan más datos y se vastifican las bases de datos de proteínas, se necesita un enfoque crítico y métodos eficaces para gestionar y analizar esta información. Los algoritmos deben ser constantemente actualizados y validados para garantizar que los modelos sean precisos y útiles.
Conclusiones sobre la modelización de proteínas
La modelización de proteínas es una herramienta esencial en el campo de la biología molecular que ofrece profundas implicaciones en la investigación, la medicina y la biotecnología. Desde sus fundamentos, técnicas y aplicaciones hasta los desafíos que enfrenta, este artículo ha proporcionado un panorama detallado sobre la importancia y el potencial de esta disciplina. A medida que la tecnología avanza, es probable que veamos un aumento en la precisión de las predicciones estructurales, así como en la capacidad para modelar interacciones biomoleculares complejas.
La modelización de proteínas no solo abre puertas para la comprensión de la biología que subyace a enfermedades humanas, sino que también puede desempeñar un papel crítico en el desarrollo de nuevos tratamientos y terapias. A medida que se superan los retos actuales, el futuro de la modelización de proteínas promete ser aún más brillante y lleno de oportunidades para el avance de la ciencia. Así, este campo, que en algunos aspectos ya se considera un aspecto indispensable en la biología moderna, se expandirá y se integrará con nuevas tecnologías y descubrimientos emocionantes.
Si quieres conocer otros artículos parecidos a Guía completa para la modelización de proteínas en biología puedes visitar la categoría Biología.



Deja una respuesta