Impacto de la tecnología en la identificación de biomarcadores
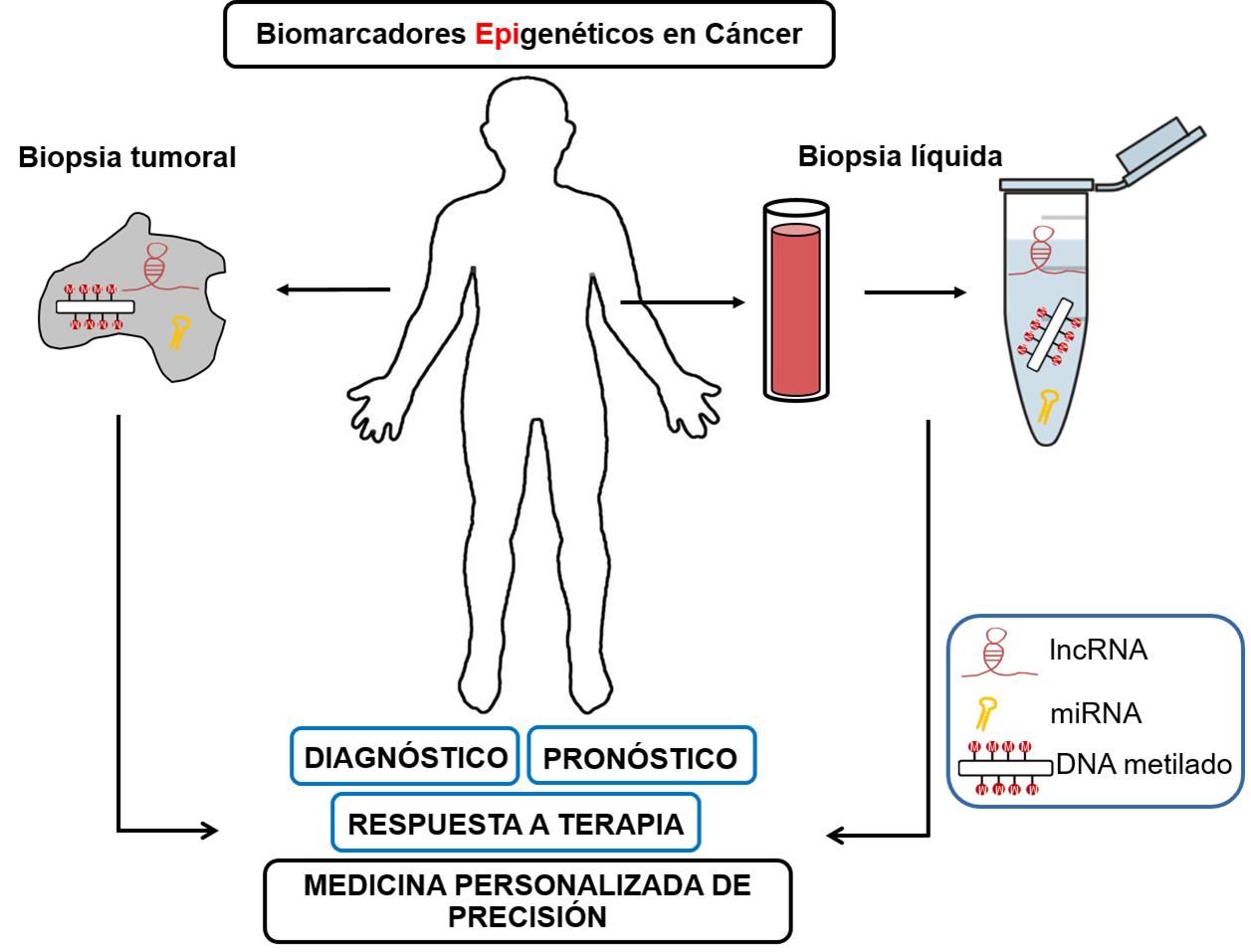
En la era actual, la tecnología avanza a pasos agigantados, transformando diversos aspectos de nuestra vida cotidiana. Uno de los campos que ha experimentado una evolución notable es el de la salud, donde el uso de la tecnología se ha vuelto fundamental para el desarrollo de nuevas técnicas y metodologías científicas. En este contexto, la identificación de **biomarcadores** se ha posicionado como un elemento crucial en la comprensión de diversas enfermedades, así como en la mejora de tratamientos y diagnósticos. Estos **biomarcadores** son indicadores biológicos que nos permiten identificar patologías de manera temprana, así como predecir la respuesta a ciertos tratamientos.
Este artículo se adentrará en el fascinante mundo del impacto de la tecnología en la identificación de **biomarcadores**. Exploraremos temas como la genómica, la proteómica y las nuevas tecnologías de análisis de datos que han revolucionado esta área. Además, discutiremos ejemplos concretos sobre cómo estas innovaciones están permitiendo la identificación y validación de **biomarcadores** en diversas condiciones de salud. A medida que avancemos, veremos cómo la sinergia entre la biología y la tecnología está abriendo nuevas puertas hacia un futuro más saludable y preciso en el campo de la medicina.
- La revolución de la genómica en la identificación de biomarcadores
- Proteómica: Decodificando las proteínas como biomarcadores
- Análisis de datos y aprendizaje automático en la identificación de biomarcadores
- Ejemplos de biomarcadores en enfermedades específicas
- Desafíos en la identificación y validación de biomarcadores
- La importancia del futuro de los biomarcadores en la medicina personalizada
- Conclusión: El futuro de los biomarcadores y la tecnología en salud
La revolución de la genómica en la identificación de biomarcadores
La genómica, el estudio del genoma, ha sido uno de los principales catalizadores de la transformación en la identificación de **biomarcadores**. Con la llegada de tecnologías como la secuenciación de ADN de próxima generación, se ha hecho posible secuenciar genomas completos a un costo mucho más accesible y en tiempos récord. Esta capacidad ha permitido a los investigadores identificar variaciones genéticas que pueden estar asociadas con diversas enfermedades. Por ejemplo, en el caso de enfermedades como el cáncer, las alteraciones en los genes pueden ser indicativas de una predisposición a desarrollar tumores, lo que convierte estas variaciones en **biomarcadores** potenciales para diagnóstico y tratamiento.
Uno de los grandes logros en este campo ha sido la creación de biobancos, que almacenan muestras biológicas y datos genéticos para futuras investigaciones. A través del análisis de las muestras de pacientes con condiciones específicas, se han identificado patrones genéticos que permiten no solo diagnosticar enfermedades, sino también comprender sus mecanismos subyacentes. Por ejemplo, la investigación en cáncer de mama ha evidenciado que ciertas mutaciones en los genes BRCA1 y BRCA2 pueden actuar como **biomarcadores** para predecir la susceptibilidad a esta enfermedad, lo que abre la puerta a estrategias de prevención y tratamiento más personalizadas.
Proteómica: Decodificando las proteínas como biomarcadores
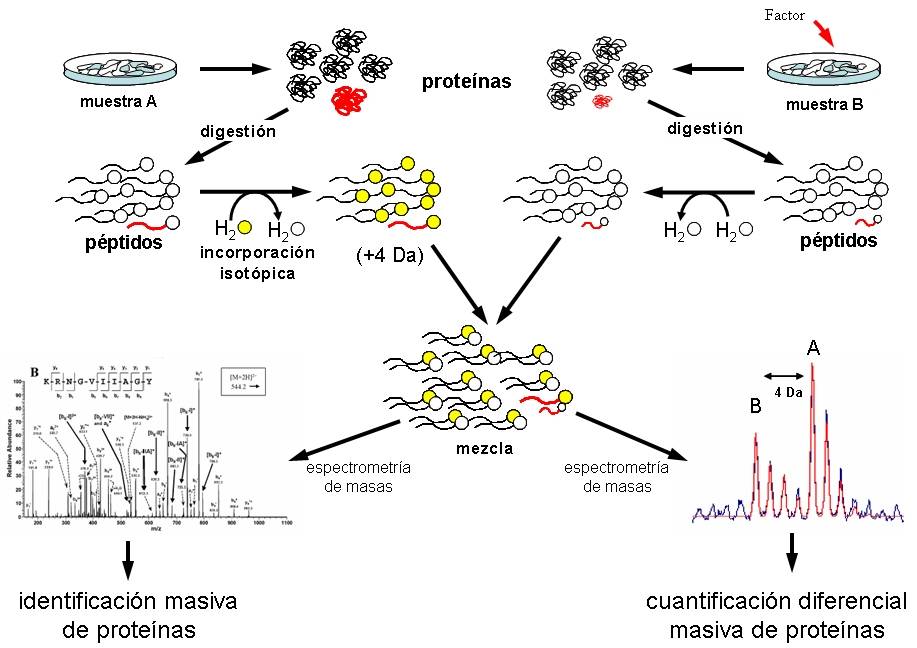
Mientras que la genómica se centra en el material genético, la proteómica se ocupa de las proteínas expresadas en las células. Las proteínas son fundamentales para el funcionamiento del organismo y pueden ofrecer información valiosa sobre el estado de salud de un individuo. La identificación de **biomarcadores** proteómicos implica analizar los perfiles de proteínas en muestras biológicas, como sangre o tejido, para detectar cambios que puedan indicar la presencia de una enfermedad.
Las tecnologías de espectrometría de masas han revolutionado la proteómica, permitiendo la identificación y cuantificación de miles de proteínas en un solo análisis. Esta capacidad ha facilitado la identificación de perfiles proteicos específicos en enfermedades como la diabetes o la enfermedad de Alzheimer. Por ejemplo, se han identificado ciertas proteínas en la sangre que pueden actuar como **biomarcadores** para el diagnóstico temprano de estas condiciones, mejorando significativamente las posibilidades de intervención oportuna. Además, el análisis de proteínas en el contexto de la proteómica también ha permitido el descubrimiento de **biomarcadores** que reflejan la respuesta a tratamientos, ayudando en la personalización de terapias en cáncer y otras enfermedades crónicas.
Análisis de datos y aprendizaje automático en la identificación de biomarcadores
El advenimiento del big data ha transformado la manera en la que se manejan y se analizan los datos en el campo de la salud. Las técnicas de análisis de datos y el **aprendizaje automático** permiten extraer información valiosa de conjuntos de datos complejos, que a menudo incluyen información genómica, proteómica y clínica. Esto ha abierto nuevas oportunidades para la identificación y validación de **biomarcadores** que de otro modo podrían pasarse por alto.
A través del uso de algoritmos avanzados, se pueden identificar patrones y correlaciones en grandes volúmenes de datos. Un ejemplo notable es el uso de modelos de **aprendizaje automático** en el análisis de imágenes médicas, donde se pueden detectar características sutiles en las imágenes que pueden corresponder a cambios patológicos. Estas tecnologías están siendo aplicadas no solo para diagnosticar enfermedades, sino también para predecir su progreso y la respuesta a tratamientos específicos. La integración de datos de diferentes fuentes, como genómica, proteómica y registros clínicos, ha llevado al desarrollo de plataformas que pueden predecir la aparición de enfermedades a través de la identificación de **biomarcadores** integrados.
Ejemplos de biomarcadores en enfermedades específicas
La utilidad de los **biomarcadores** se ha demostrado en diversas áreas de la medicina. En el caso de enfermedades autoinmunitarias, como la artritis reumatoide, se han identificado biomarcadores que indican la actividad de la enfermedad y su respuesta a los tratamientos. Estos **biomarcadores** pueden usarse para ajustar terapias y mejorar la calidad de vida de los pacientes.
En el contexto del cáncer, el uso de **biomarcadores** se ha convertido en una práctica habitual. El antígeno prostático específico (PSA) es un biomarcador utilizado en el diagnóstico y seguimiento del cáncer de próstata. La medición de los niveles de PSA puede ayudar a detectar la enfermedad en etapas tempranas y a monitorear la respuesta al tratamiento. Otro ejemplo es el HER2, cuya sobreexpresión en algunos cánceres de mama puede guiar las decisiones de tratamiento, permitiendo el uso de terapias específicas que impiden el crecimiento del tumor.
Además, en enfermedades neurodegenerativas como el Alzheimer, el análisis de biomarcadores en el líquido cefalorraquídeo ha permitido el diagnóstico precoz y la identificación de individuos en riesgo. Esto es crucial, ya que permite la implementación de intervenciones antes de que se produzcan daños irreversibles en el cerebro.
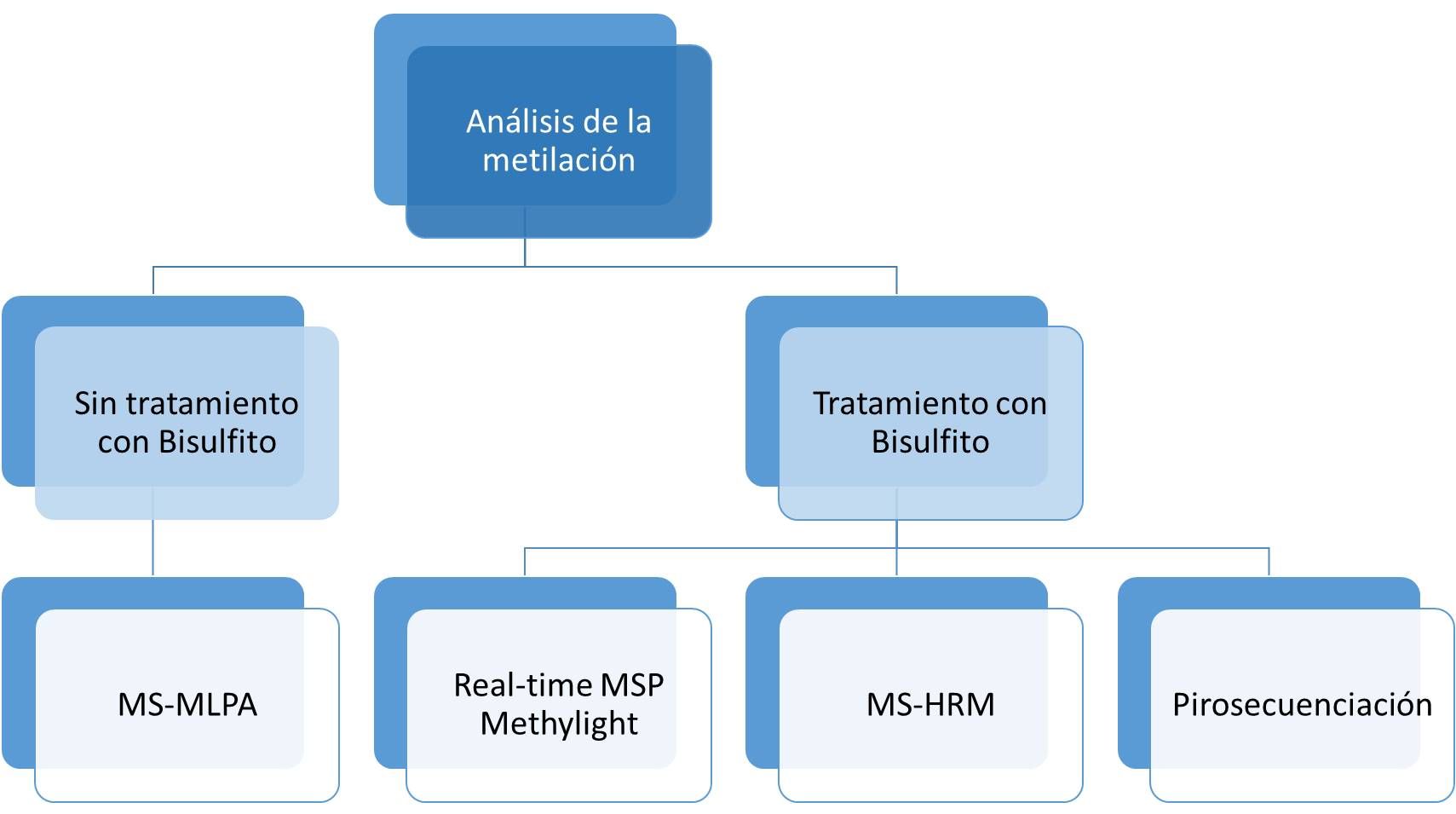
Desafíos en la identificación y validación de biomarcadores
A pesar de los avances significativos, la identificación y validación de **biomarcadores** no están exentas de desafíos. Uno de los principales retos es la necesidad de replicar los estudios en diferentes poblaciones y condiciones para asegurar que los **biomarcadores** son realmente específicos y sensibles. La variabilidad biológica entre individuos puede influir en los resultados y complicar la identificación de **biomarcadores** que sean aplicables en la práctica clínica general.
Además, la interpretación de los resultados en el contexto clínico es a menudo compleja. La identificación de un **biomarcador** puede llevar a un diagnóstico, pero la definición de su relevancia clínica y cómo debe traducirse en decisiones de tratamiento requiere un enfoque cuidadoso. La colaboración interdisciplinaria entre genetistas, bioquímicos, médicos y tecnólogos es esencial para superar estos problemas y poder traducir el potencial de los **biomarcadores** en beneficios prácticos para los pacientes.
La importancia del futuro de los biomarcadores en la medicina personalizada
La creciente intersección entre la tecnología y la biomedicina sugiere que el futuro de la identificación de **biomarcadores** será aún más prometedor. Con la posibilidad de analizar junto a la información clínica, los datos genómicos y proteómicos de manera integrada, se está abriendo un campo inmenso para la medicina personalizada. La idea de que cada paciente es único, y por lo tanto, merece un tratamiento adaptado a sus circunstancias específicas, se apoya en la identificación de **biomarcadores**.
La medicina personalizada, impulsada por los **biomarcadores**, tiene el potencial de revolucionar nuestra aproximación al tratamiento de enfermedades complejas, desde el cáncer hasta enfermedades cardiovasculares y metabólicas. Los **biomarcadores** no solo prometen mejorar el diagnóstico y la predicción de enfermedades, sino que también pueden jugar un papel importante en la identificación de tratamientos más efectivos, reduciendo así el tiempo y los recursos invertidos en intervenciones que pueden no ser efectivas para todos los pacientes.
Conclusión: El futuro de los biomarcadores y la tecnología en salud
El impacto de la tecnología en la identificación de **biomarcadores** está transformando la práctica médica y la investigación biológica. Desde la genómica y la proteómica hasta el análisis de datos y el aprendizaje automático, cada avance ha contribuido a nuestro entendimiento de las enfermedades y a la posibilidad de personalizar los tratamientos para cada paciente. Sin embargo, los desafíos en la validación y la aplicación de estos **biomarcadores** son considerables, y requerirán un esfuerzo conjunto de múltiples disciplinas y la colaboración global. Al mirar hacia el futuro, es claro que la tecnología continuará desempeñando un papel fundamental en el avance de la salud y la mejora de la calidad de vida de millones de personas en todo el mundo. A medida que continuemos desarrollando y aplicando nuevos enfoques para la identificación y uso de **biomarcadores**, la medicina personalizada se convertirá en una realidad aún más palpable, ofreciendo esperanza para un futuro más saludable.
Si quieres conocer otros artículos parecidos a Impacto de la tecnología en la identificación de biomarcadores puedes visitar la categoría Biomarcadores.




Deja una respuesta