Qué es el modelado atómico en proteína-ligando
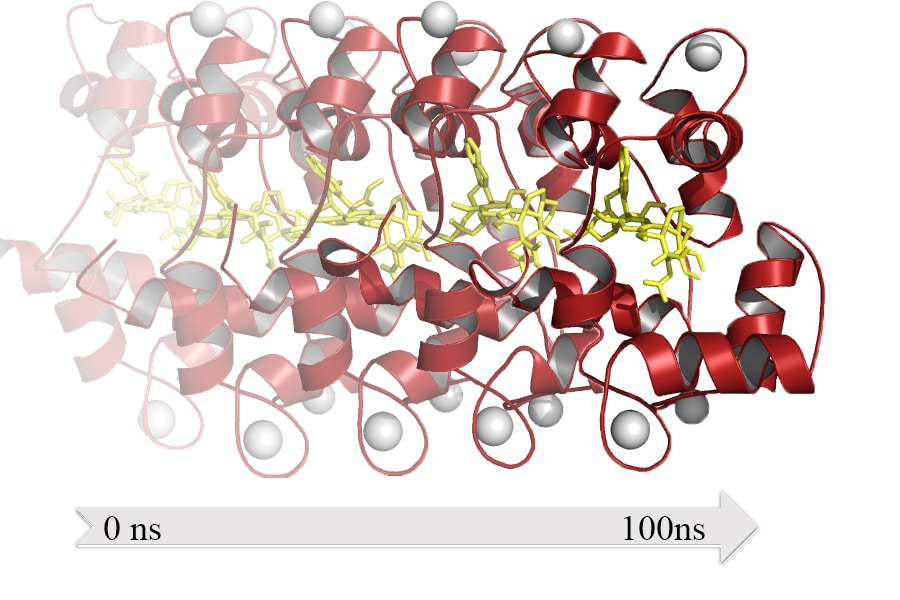
El **modelado atómico en proteína-ligando** se ha convertido en una herramienta fundamental en el campo de la biología estructural y la biología molecular. La comprensión de cómo las **proteínas** interactúan con **ligandos** a nivel atómico no solo es crucial para el desarrollo de nuevos fármacos, sino que también proporciona información valiosa sobre el funcionamiento biológico en general. Las **interacciones proteína-ligando** determinan una serie de procesos bioquímicos esenciales, desde la señalización celular hasta la regulación enzimática, lo que hace que su estudio sea prioritario en la investigación científica actual.
Este artículo explorará en profundidad qué es el modelado atómico en proteína-ligando, su importancia en la investigación biomédica y los métodos utilizados para llevarlo a cabo. Abordaremos aspectos fundamentales como la definición de las proteínas y los ligandos, los diferentes métodos de modelado, la relevancia del modelado en el descubrimiento de fármacos y los desafíos que enfrentan los científicos en este campo. Al finalizar, los lectores comprenderán no solo el proceso en sí, sino también su impacto en la ciencia y la medicina.
Definición de proteínas y ligandos
Para entender el **modelado atómico en proteína-ligando**, es crucial conocer primero qué son las **proteínas** y los **ligandos**. Las **proteínas** son macromoléculas compuestas de cadenas de aminoácidos que cumplen una amplia variedad de funciones en los organismos vivos. Desde catalizar reacciones químicas hasta proporcionar estructura y soporte a las células, las proteínas son esenciales para la vida. Su forma tridimensional y cómo esta estructura se pliega dependen de las interacciones entre los aminoácidos, así como del entorno en el que se encuentran. Cada proteína tiene un sitio específico, conocido como sitio de unión, donde puede interactuar con otros compuestos, como los ligandos.
Los **ligandos**, por otro lado, son generalmente pequeños compuestos que se unen a las proteínas en sitios de unión específicos. Pueden ser sustratos, inhibidores o incluso moléculas de señalización que modulan la actividad de la proteína. La naturaleza de estas interacciones es a menudo específica y puede desencadenar una serie de respuestas bioquímicas, lo que hace que su estudio sea tan relevante para la biología y la medicina. En este contexto, el modelado atómico se utiliza para predecir y visualizar cómo estas interacciones ocurren a nivel atómico.
Métodos de modelado atómico en proteína-ligando
Existen varios métodos de **modelado atómico** que se utilizan en el estudio de las interacciones proteína-ligando. Estos métodos se pueden clasificar en enfoques computacionales y experimentales. Los métodos computacionales incluyen la **docking molecular**, la **dinámica molecular** y la **modelización por homología**, mientras que los enfoques experimentales se centran en técnicas como la cristalografía de rayos X y la espectroscopía de resonancia magnética Nuclear (RMN).
El **docking molecular** es una técnica que permite predecir la interacción entre una proteína y un ligando a través de simulaciones computacionales. Este método implica la búsqueda de las conformaciones y orientaciones más favorables en las que un ligando puede unirse a la proteína. Utiliza modelos de energía para evaluar la estabilidad de las diferentes interacciones y proporciona información valiosa sobre los modos de unión.
Otra técnica importante es la **dinámica molecular**, que simula el movimiento de átomos y moléculas a lo largo del tiempo. Este enfoque permite estudiar cómo las proteínas y los ligandos se comportan en condiciones fisiológicas, proporcionando información sobre las interacciones que pueden no ser evidentes en imágenes estáticas. Al observar la evolución temporal de las estructuras, los científicos pueden obtener una comprensión más profunda de la interacción y su estabilidad.
Por último, la **modelización por homología** se utiliza cuando la estructura de una proteína de interés no se conoce, pero sí se dispone de estructuras similares. Este método implica utilizar información de proteínas homologas para predecir la estructura y, posteriormente, el comportamiento de una proteína al unirse a un ligando. Al combinar estos enfoques, los investigadores pueden obtener un panorama más completo sobre el modelado atómico de proteína-ligando.
Importancia del modelado atómico en el descubrimiento de fármacos
El **modelado atómico en proteína-ligando** es una herramienta invaluable en el campo del descubrimiento de fármacos. Las interacciones específicas entre proteínas y ligandos pueden ser utilizadas para diseñar nuevos compuestos que se unan a proteínas diana de manera eficaz, lo que puede llevar al desarrollo de medicamentos más efectivos. El modelado permite a los investigadores identificar rápidamente los compuestos más prometedores para llevar a cabo ensayos adicionales, reduciendo así el tiempo y los recursos necesarios en el proceso de descubrimiento de fármacos.
Además, el modelado atómico también puede ayudar a optimizar las propiedades farmacocinéticas y farmacodinámicas de las moléculas candidato. Es posible ajustar la estructura de un ligando para aumentar su afinidad por su proteína diana, mejorar su solubilidad y biodisponibilidad, o reducir su toxicidad. Este proceso de optimización es vital para desarrollar medicamentos seguros y efectivos.
El modelado atómico proporciona una plataforma donde se pueden explorar las interacciones entre proteínas y ligandos a un nivel detallado. Esto abre un abanico de oportunidades en la investigación biomédica, permitiendo crear tratamientos más dirigidos y eficaces.
Desafíos en el modelado atómico
A pesar de sus numerosas ventajas, el **modelado atómico en proteína-ligando** también enfrenta varios desafíos significativos. Uno de los principales problemas es la precisión de los modelos computacionales. Por ejemplo, en ocasiones, la actividad biológica de un ligando puede ser alterada por la forma en que se simulan las interacciones atómicas. Si los parámetros de energía o las estructuras iniciales no son precisos, eso puede llevar a predicciones erróneas sobre cómo se unirá un ligando a una proteína.
Asimismo, las proteínas son entidades dinámicas que no permanecen en una sola conformación. Esta variabilidad puede no ser capturada adecuadamente en un modelo estático, lo que lleva a resultados inexactos. Para abordar este problema, cada vez es más común aplicar enfoques híbridos que combinan datos experimentales con simulaciones computacionales, logrando así un equilibrio entre precisión y eficiencia.
Otro desafío es la necesidad de grandes recursos computacionales. Las simulaciones a nivel atómico pueden ser extremadamente exigentes, y la cantidad de datos generados puede dificultar el análisis. Esto exige el uso de tecnologías avanzadas y la colaboración interdisciplinaria para desarrollar mejores herramientas y métodos que optimicen el proceso de modelado.
Conclusión
El **modelado atómico en proteína-ligando** se presenta como una poderosa herramienta en la investigación biomédica, ofreciendo un entendimiento profundo de las interacciones que rigen las funciones biológicas. Desde su capacidad para facilitar el descubrimiento de nuevos fármacos hasta su papel en la optimización de moléculas terapéuticas, este campo continúa evolucionando y refinándose. Aunque enfrenta numerosos desafíos, como la precisión del modelado y la demanda de recursos computacionales, la integración de tecnologías avanzadas y la colaboración entre disciplinas promete resolver estos obstáculos y potenciar aún más sus aplicaciones en la salud y la medicina. En última instancia, cada avance en el modelado atómico acerca a la ciencia un paso más a la creación de tratamientos personalizados y eficaces, que podrían revolucionar el manejo de diversas enfermedades.
Si quieres conocer otros artículos parecidos a Qué es el modelado atómico en proteína-ligando puedes visitar la categoría Modelado.

Deja una respuesta