Técnicas de bioinformática en farmacogenómica: una exploración

La bioinformática ha emergido como una pieza clave en la investigación científica contemporánea, especialmente en campos altamente complejos como la farmacogenómica. Este ámbito de estudio, que examina cómo las variaciones en el genoma de un individuo afectan su respuesta a los fármacos, se ha beneficiado enormemente de las técnicas y herramientas que aporta la bioinformática. En un mundo donde la medicina personalizada se perfila como el futuro de la atención sanitaria, la interacción entre la bioinformática y la farmacogenómica está más presente que nunca.
Este artículo tiene como objetivo explorar las diversas técnicas de bioinformática que se utilizan en el campo de la farmacogenómica. Abordaremos desde el análisis de datos genómicos hasta la modelación de interacciones fármaco-proteína, pasando por la identificación de biomarcadores y la integración de datos multi-ómicos. A través de este recorrido, se espera ofrecer una comprensión profunda de cómo estas herramientas y técnicas no solo avanzan el conocimiento científico, sino que también tienen el potencial de transformar la práctica clínica y optimizar la terapia farmacológica.
La importancia de la bioinformática en farmacogenómica
La farmacogenómica se centra en la relación entre la genética y la respuesta a los medicamentos, lo que permite que los médicos seleccionen y ajusten tratamientos personalizados. Sin embargo, para desarrollar esta medicina personalizada, es esencial contar con herramientas que puedan analizar y interpretar la vasta cantidad de datos genéticos. Aquí es donde la bioinformática juega un papel crucial, ya que proporciona metodologías computacionales y estadíticas para gestionar estos datos. Las bases de datos genéticos, los sistemas de análisis de datos y la simulación se convierten en recursos fundamentales para los investigadores y clínicos que buscan entender cómo las variaciones genéticas influyen en la farmacodinámica y farmacocinética de los medicamentos.
Además, la bioinformática permite la integración de datos de diferentes fuentes, desde información clínica hasta datos genómicos y proteómicos. Esta habilidad de integrar múltiples capas de información es vital para identificar patrones que pueden no ser evidentes en un solo conjunto de datos. Sin ella, sería extremadamente difícil extraer conclusiones significativas que puedan ser aplicadas en la práctica clínica.
Análisis de datos genómicos en farmacogenómica
El primer paso en cualquier estudio farmacogenómico es el análisis de datos genómicos. Esto implica el uso de técnicas de secuenciación de última generación, que generan grandes volúmenes de datos acerca de múltiples genomas. Los algoritmos de alineamiento de secuencias son vitales en este proceso, ya que permiten mapear las secuencias obtenidas a un genoma de referencia. Herramientas como Bowtie y BWA (Burrows-Wheeler Aligner) son ejemplos de software utilizado para este fin. Estas herramientas son capaces de gestionar la enorme cantidad de datos que se generan, permitiendo a los investigadores centrarse en las variaciones genéticas que podrían influir en la respuesta a los fármacos.
Una vez que se han alineado las secuencias, es esencial identificar las variantes genéticas. El uso de herramientas como GATK (Genome Analysis Toolkit) permite a los investigadores detectar Polimorfismos de Nucleótido Único (SNPs) y otros tipos de variaciones. Identificar estas variantes es un paso clave, ya que muchas de ellas pueden ser responsables de diferencias en la eficacia y la toxicidad de los medicamentos en diferentes poblaciones o incluso en individuos. Este proceso es fundamental para el desarrollo de paneles de pruebas genéticas que permitirán a los médicos seleccionar tratamientos adecuados para sus pacientes.
Identificación de biomarcadores
La identificación de biomarcadores es otra aplicación crucial de la bioinformática en farmacogenómica. Los biomarcadores son indicadores biológicos que pueden predecir cómo un paciente responderá a ciertos tratamientos. La bioinformática facilita la extrapolación de datos complejos, permitiendo que los investigadores identifiquen biomarcadores potenciales asociados con la eficacia terapéutica o la tolerancia a un fármaco específico.
Por ejemplo, se están utilizando técnicas de aprendizaje automático y minería de datos para analizar grandes conjuntos de datos clínicos y genéticos. Esto incluye el uso de algoritmos que permiten clasificar a los pacientes según su perfil genético y predecir su respuesta a diferentes fármacos. Herramientas como R y Python son ampliamente utilizadas para aplicar estas técnicas, proporcionando un marco para trabajar con datos complejos y extraer información valiosa que puede ser utilizada en la práctica clínica.
Modelación de interacciones fármaco-proteína
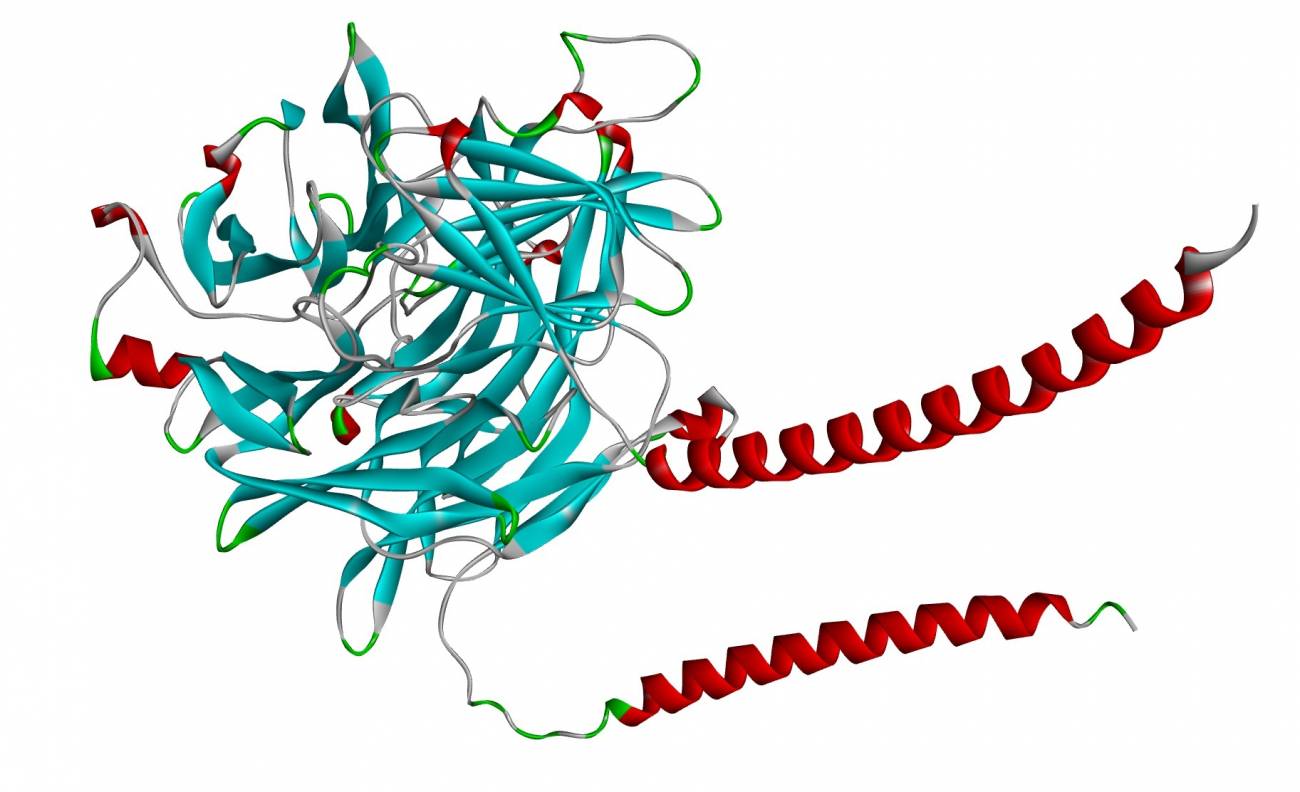
Otra técnica fundamental dentro de la bioinformática es la modelación de interacciones fármaco-proteína. Esta técnica se utiliza para predecir cómo un fármaco interactuará con su objetivo molecular, facilitando el diseño de medicamentos más eficaces. Usando simulaciones computacionales, los investigadores pueden estudiar cómo las propiedades químicas de un fármaco se ajustan a las características de forma de la proteína objetivo, lo que les permite prever componentes de eficacia y toxicidad.
Herramientas como AutoDock y MOE (Molecular Operating Environment) permiten realizar estas simulaciones. A través de la modelación y el análisis de estructuras proteicas, los investigadores pueden optimizar los compuestos antes de proceder a la síntesis y pruebas en el laboratorio. Esto no solo acelera el proceso de desarrollo de medicamentos, sino que también puede llevar a la identificación de nuevos usos para fármacos ya existentes, un área conocida como reposicionamiento de fármacos.
Integración de datos multi-ómicos
La integración de datos multi-ómicos, que combina datos genómicos, transcriptómicos, proteómicos y metabolómicos, es otro avance importante facilitado por la bioinformática en farmacogenómica. Esta integración permite a los investigadores obtener una visión holística de las interacciones biológicas que influyen en la respuesta de los pacientes a los fármacos. Por ejemplo, los datos transcriptómicos pueden proporcionar información sobre la expresión de genes específicos, mientras que los datos proteómicos pueden ofrecer información sobre las proteínas que se producen y sus funciones biológicas.
El uso de técnicas de big data y computación en la nube ha revolucionado la forma en que se gestionan y analizan estos vastos conjuntos de datos. Plataformas como Galaxy y BioBlend facilitan la manipulación y el análisis de datos multi-ómicos, permitiendo a los investigadores integrar la información para mejorar la comprensión de los mecanismos biológicos subyacentes. Esta visión integrada es fundamental para identificar nuevos biomarcadores y tratamientos personalizados que aborden de manera más efectiva las enfermedades.
Desafíos y futuro de la bioinformática en farmacogenómica
A pesar de los avances significativos, la bioinformática enfrenta varios desafíos en el campo de la farmacogenómica. La variabilidad genética entre poblaciones es un factor que puede complicar la interpretación de los datos. Los investigadores deben tener en cuenta la diversidad genética y los factores ambientales que pueden influir en la respuesta a los medicamentos. Además, la interoperabilidad de los datos y las herramientas es crucial para que los investigadores puedan colaborar de manera efectiva y aprovechar al máximo los recursos disponibles.
El futuro de la bioinformática en farmacogenómica parece prometedor. A medida que la tecnología siga avanzando, será posible realizar análisis más profundos y precisos. La implementación de inteligencia artificial y aprendizaje automático en la investigación farmacogenómica tiene el potencial de transformar enormemente el campo, brindando a los investigadores la capacidad de hacer predicciones más precisas sobre la eficacia de un tratamiento basado en el perfil genético de un paciente. Este enfoque podría mejorar drásticamente la personalización de la medicina, asegurando que los pacientes reciban los medicamentos más adecuados para sus características individuales.
Conclusión
La sinergia entre la bioinformática y la farmacogenómica está configurando el futuro de la medicina personalizada. Desde la identificación de biomarcadores hasta la modelación de interacciones fármaco-proteína, las técnicas de bioinformática están revolucionando la forma en que se investiga y se aplican los tratamientos. A medida que se superan los desafíos actuales y se avanza en la integración de datos multi-ómicos, el papel de la bioinformática en este campo seguirá creciendo, ofreciendo una visión más detallada y completa del genoma humano y sus interacciones con la terapia farmacológica. Con esto, nos acercamos a un futuro donde las decisiones médicas pueden ser feitas con base en la individualidad genética de los pacientes, mejorando la eficacia de los tratamientos y reduciendo el riesgo de efectos adversos.
Si quieres conocer otros artículos parecidos a Técnicas de bioinformática en farmacogenómica: una exploración puedes visitar la categoría Aplicaciones.


Deja una respuesta